Strukturelle og molekylære formel: acetylen
Funktioner af strukturen af acetylen påvirker dets egenskaber, produktion og anvendelse. Den konventionelle betegnelse af stoffet - C2H2 Er dens enkleste og brutto formel. Acetylen dannes af to carbonatomer, mellem hvilke der er en tredobbelt binding. Dens tilstedeværelse afspejler forskellige typer af formler og modeller af ethylenmolekylet, hvilket gør det muligt at forstå problemet med strukturens indflydelse på stoffets egenskaber.
Alkyner. Den generelle formel. acetylen
Alkylcarbonhydrider eller acetylen eracykliske, umættede. Kæden af carbonatomer er ikke lukket, der er enkle og flere bindinger i den. Sammensætningen af alkyner afspejler den summariske formel CnH2n - 2. I molekylerne af stoffer i denne klasse er deren eller flere tredobbelte bindinger. Acetylenforbindelser henviser til umættede forbindelser. Dette betyder, at kun en kulstofvalens er realiseret på grund af hydrogen. De resterende tre bindinger anvendes, når de interagerer med andre carbonatomer.
Den første - og den mest berømte repræsentantalkyner-acetylen eller ethyn. Det trivielle navn på stoffet kommer fra det latinske ord "acetum" - "eddike" og græsk - "hyle" - "træ". Grundlæggeren af den homologe serie blev opdaget i 1836 i kemiske forsøg, senere blev stoffet syntetiseret fra kul og hydrogen af E. Davy og M. Bertlo (1862). Ved normal temperatur og normalt atmosfæretryk er acetylen i en gasformig tilstand. Det er en farveløs gas, lugtfri, lidt opløselig i vand. Etin er lettere opløseligt i ethanol og acetone.

Molekylær formel af acetylen
Etin - det enkleste medlem af sin homologe serie, dets sammensætning og struktur afspejler formlerne:
- C2H2 - molekylær optagelse af sammensætningen af ethan, hvilket giverforestillingen om, at et stof dannes af to carbonatomer og det samme antal hydrogenatomer. Ifølge denne formel kan molekylære og molære masser af forbindelsen beregnes. Hr2H2) = 26 a. e. m., M (C2H2) = 26,04 g / mol.
- Н: С ::: С: Н - acetylenens elektron-dot-formel. Lignende billeder, kaldet "Lewis strukturer", afspejler molekylets elektroniske struktur. Ved skrivning er det nødvendigt at overholde reglerne: hydrogenatomet har tendens til at have konfigurationen af heliums valensskal i dannelsen af en kemisk binding, de andre elementer - ved en oktet af eksterne elektroner. Hvert kolon betyder en fælles for de to atomer eller et ikke-delt par elektroner på det eksterne energiniveau.
- H-C≡C-H er strukturformlen for acetylen, som afspejler rækkefølgen og mangfoldigheden af bindinger mellem atomer. Et bindestreg erstatter et par elektroner.
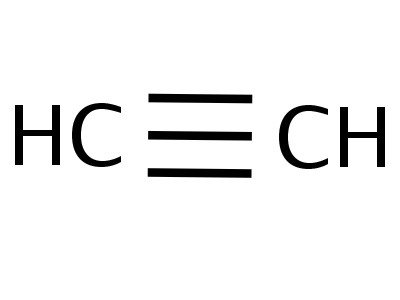
Modeller af acetylenmolekylet
Formler, der viser fordelingen af elektroner,tjente som grundlag for oprettelsen af atom-orbitale modeller, rumlige formler af molekyler (stereokemisk). Så tidligt som i slutningen af det 18. århundrede blev sfæriske stangmodeller udbredt - for eksempel kugler af forskellig farve og størrelse, der betegner kulstof og hydrogen, som danner acetylen. Strukturen af et molekyle er repræsenteret i form af stave, som symboliserer de kemiske bindinger og deres antal i hvert atom.

Den sfæriske model af acetylen reproducerervalensvinkler svarende til 180 °, men de indre kerneafstande i molekylet reflekteres omtrent. Hulrummene mellem kuglerne skaber ikke et billede af påfyldningen af rummen af atomer med elektrontæthed. Ulempen er elimineret i modellerne af Driding, som betegner atomkernerne ikke med bolde, men med stifterne af stængerne til hinanden. Moderne volumetriske modeller giver en mere levende ide om atom- og molekylære orbitaler.
Hybridatomiske orbitaler af acetylen
Kulinet i den ophidsede tilstand indeholder tre p-orbitaler og en s med opparerede elektroner. Ved dannelsen af methan (CH4) de deltager i oprettelsen af tilsvarendebindinger med hydrogenatomer. Den berømte amerikanske forsker L. Pauling udviklede teorien om hybrid tilstand af atomorbitaler (AO). Forklaringen af carbonens opførsel i kemiske reaktioner er justeringen af AO i form og energi, dannelsen af nye skyer. Hybride orbitaler giver stærkere forbindelser, formlen bliver mere stabil.
Atomer af kulstof i acetylenmolekylet, i modsætning tilmethan, undergår sp-hybridisering. S og p elektroner blandes i form og energi. To sp-orbitaler vises, liggende i en vinkel på 180 °, rettet på modsatte sider af kernen.

Triple forbindelse
I acetylenhybride elektroniske skyer af kulstofdeltage i oprettelsen af σ-bindinger med de samme nærliggende atomer og med hydrogen i CH-par. Der forbliver to ikke-hybrid-p-orbitaler vinkelret på hinanden. I ethylenmolekylet deltager de i dannelsen af to π-bindinger. Sammen med σ er der en tredobbelt obligation, som afspejler strukturformlen. Acetylen adskiller sig fra ethan og ethylen med afstanden mellem atomer. Den tredobbelte binding er kortere end den dobbelte, men har en større energibesparelse, er mere solid. Den maksimale tæthed af σ- og π-bindinger er placeret i vinkelrette områder, hvilket fører til dannelsen af en cylindrisk elektronsky.
Egenskaber af den kemiske binding i acetylen
Ethylenmolekylet har en lineær form, som er vellykketafspejler den kemiske formel af acetylen - H-C≡C-H. Kul- og hydrogenatomer er langs en ret linje, mellem dem er der 3 σ- og 2 π-bindinger. Fri bevægelighed, rotation langs aksen C-C er umulig, dette forhindres ved tilstedeværelsen af flere bindinger. Andre træk i triple bond:
- Antallet af elektroner, der forbinder to carbonatomer, er 3;
- længde - 0.120 nm;
- Energien i brud er 836 kJ / mol.
Til sammenligning: i ethan og ethylenmolekyler er længden af de enkelt- og dobbeltkemiske bindinger henholdsvis 1,54 og 1,34 nm, energien i C-C-rupturen er 348 kJ / mol, C = C-614 kJ / mol.

Homologer af acetylen
Acetylen er den enkleste repræsentant for alkyner, hvis molekyler også har en tredobbelt binding. Propyn CH3С≡СН - homolog af acetylen. Formel for den tredje repræsentant for alkyner - butyn-1-CH3CH2S≡SN. Acetylen er det trivielle navn af etan. Den systematiske nomenklatur for alkyner er underlagt IUPAC-reglerne:
- I lineære molekyler tilføjes navnet på hovedkæden, der stammer fra det græske tal, hvortil suffiksen -in og antallet af atomet tilsættes med en tredobbelt binding, for eksempel ethyn, propyn, butyn-1;
- nummereringen af hovedkæden af atomer begynder ved enden af molekylet nærmest den tredobbelte binding;
- For forgrenede carbonhydrider følges navets gren først efterfulgt af navnet på hovedkæden af atomer med suffikset -in.
- Den sidste del af navnet - et tal, der angiver placeringen af triplebinding i molekylet, for eksempel butyn-2.

Isomerisme af alkyner. Afhængighed af egenskaber på struktur
Ethin og propyn har ikke isomerer af det tredobbeltede vises, begyndende med Butin. Isomererne af carbonskeletet er i pentin og de følgende homologer. Den rumlige isomerisme af acetylencarbonhydrider er ikke manifesteret i forhold til triplebindingen.
De første 4 ethanolhomologer er gasser, der er dårligt opløselige i vand. Acetylencarbonhydrider C5 - C15 - væske. De faste stoffer er homologer af ethan, ud fra carbonhydrid C17. Den alkynes kemiske natur gennemgåren signifikant indflydelse af den tredobbelte binding. Kulbrinter af denne type er mere aktive end ethylen, og forskellige partikler er bundet. Denne ejendom er baseret på den udbredt anvendelse af ethan inden for industri og teknik. Ved forbrænding af acetylen frigøres en stor mængde varme, som finder anvendelse ved gasskæring og svejsning af metaller.
</ p>